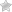Содержание
Катаболизм пуриновых нуклеотидов. Образование и удаление мочевой кислоты из организма. Гиперурекимия и подагра.
Количество небелкового азота в цельной крови и плазме почти одинаково и составляет от 15 до 25 ммоль/л. Небелковый азот крови включает азот мочевины (50% от общего количества небелкового азота), аминокислоты (25%), эрготионеин (8%), мочевую кислоту (4%), креатин (5%), креатинин (2,5%), аммиак и индикан (0,5%) и другие небелковые вещества, содержащие азот (полипептиды, нуклеотиды, нуклеозиды, глутатион, билирубин, холин, гистамин и др.). Таким образом, основную часть небелкового азота составляют конечные продукты обмена простых и сложных белков. Небелковый азот крови также называют остаточным азотом, то есть оставшимся в фильтрате после осаждения белков. У здорового человека колебания содержания небелкового (остаточного) азота крови незначительны и в основном зависят от количества поступающих с пищей белков. При острой почечной недостаточности концентрация мочевины в крови достигает 50-83 ммоль/л (норма 3,3-6,6 ммоль/л). Повышение содержания мочевины в крови до 16-20 ммоль/л (в расчете на азот мочевины) является признаком нарушения функции почек средней тяжести, до 35 ммоль/л – тяжелым и свыше 50 ммоль/л – очень тяжелым нарушением с неблагоприятным прогнозом. Иногда определяют отношение азота мочевины крови к остаточному азоту крови (в процентах). (Азот мочевины)/(Остаточный азот) X 100. К важным небелковым азотистым веществам крови относится мочевая кислота. Напомним, что у человека мочевая кислота является конечным продуктом обмена пуриновых оснований. В норме концентрация мочевой кислоты в цельной крови составляет 0,18-0,24 ммоль/л (в сыворотке крови – около 0,29 ммоль/л). Повышение содержания мочевой кислоты в крови (гиперурикемия) является главным симптомом подагры. При подагре уровень мочевой кислоты в сыворотке крови возрастает до 0,5-0,9 ммоль/л и даже до 1,1 ммоль/л. В состав остаточного азота входит также азот аминокислот и полипептидов. В крови постоянно содержится некоторое количество свободных аминокислот.
Свертывающая система крови. Внутренний и внешний путь свертывания крови.
Система свертывания крови и фибринолиз – это единая система, которая выполняет следующие функции: 1. Поддержание крови в сосудах в жидком состоянии. 2. Осуществление гемостаза (предотвращение больших кровопотерь). Гемостаз – сложный ферментативный процесс, в результате которого образуется кровяной сгусток. Система свертывания крови – это многокомпонентная система, в состав которой входят белки, фосфолипиды, обломки клеточных мембран и ионы кальция. Компоненты системы свертывания крови принято называть "факторами". Факторы бывают тканевыми, плазменными и тромбоцитарными. Тканевые и плазменные факторы обозначаются римскими цифрами, а тромбоцитарные – арабскими. Если фактор является активным, то за цифрой ставится буква "а". Большинство белков системы свертывания крови обладает ферментативной активностью. Все факторы свертывания крови, кроме фХШ, являются сериновыми протеиназами, которые катализируют реакции ограниченного протеолиза. В ходе реакций свертывания крови все белки-ферменты сначала выступают в роли субстрата, а затем – в роли фермента. Среди белков, участвующих в свертывании крови, есть такие, которые не обладают ферментативной активностью, но специфически ускоряют протекание ферментативной реакции. Они называются параферментами. Это фV и фVIII. Большинство факторов свертывания крови синтезируется в неактивной форме в виде проферментов. Проферменты активируются и их действие направлено на протекание прямой реакции свертывания крови – на превращение фибриногена в фибрин, которой является основой кровяного сгустка. Есть 2 механизма свертывания крови – внешний и внутренний. Внешний механизм запускается с участием внешних (тканевых) факторов, внутренний – при участии факторов, источником которых служит сама кровь, плазма, собственно ферменты и форменные элементы крови. Различают внешний и внутренний механизмы только начальными стадиями до активации протромбина (фI I ). Последующие стадии протекают одинаково и в том, и в другом случаях. Начальные стадии внешнего механизма. Для пуска внешнего механизма необходим первичный сигнал: повреждение тканей (клеток), оказавшихся в контакте с кровью, или эндотелия сосуда. При этом разрушаются клеточные мембраны и из клеток высвобождается тканевой тромбопластин (фШ). Он активирует фVП. Активация фVII, а также все последующие реакции до активации протромбина протекают на матрице, которая состоит из липопротеиновых осколков клеточных мембран. В ходе активации фVII происходит конформационная перестройка его молекулы, в результате формируется активный центр этого белка-фермента. Активный фVIIа образует комплекс с тканевыми фосфолипидами и ионом кальция. Этот комплекс обладает протеолитической активностью и вызывает активацию фактора X. Активный фактор Ха тоже обладает протеолитической активностью и активирует протромбин. Начальные стадии внешнего механизма. Начальные стадии внутреннего механизма называются "контактная фаза" или "контактная стадия". Происходит контакт фXII с чужеродной поверхностью (например, игла шприца, лезвие ножа, стекло). В результате происходит конформационная перестройка фХII и он активируется – переходит в фХIIа Активация фХII, а также последующие, реакции внутреннего механизма, так же, как и при внешнем механизме, протекают на матрице – тромбопластине, который освобождается при разрушении тромбоцитов. Xlla действует на XI, превращая его в Х1а. Х1а действует на ф1Х (обязательно в присутствии ионов кальция!), и переводит его в ф1Ха. ф1Ха образует комплекс с тромбоцитарными фосфолипидами, ионами кальция и параферментом – фVIIIа. В составе этого комплекса ф1Ха обладает протеолитической активностью и переводит фХ в фХа. Следующие стадии, начиная с активации протромбина (ф!1), протекают одинаково для обоих механизмов свертывания крови.
Основные антикоагулянты крови: антитромбин III, макроглобулин, антиконвертин. Антикоагулянтный путь.
АНТИКОАГУЛЯНТЫ. Естественные антикоагулянты синтезируются в тканях и поступают в кровь, где препятствуют активации факторов свертывания крови. К ним относятся ГЕПАРИН, АНТИТРОМБИН-III и альфа-2-МАКРОГЛОБУЛИН. ГЕПАРИН предотвращает активацию некоторых факторов, но непосредственно на них не действует. Гепарин способен активировать АНТИТРОМБИН-Ш. Обладая высоким отрицательным зарядом, гепарин связывается с катионными участками антитромбина- III. В результате изменяется конформация антитромбина- III и он приобретает способность инактивировать сериновые протеиназы. альфа-2-МАКРОГЛОБУЛИН – эндогенный ингибитор протеаз, в том числе многих ферментов, участвующих в работе системы свертывания крови и фибринолиза (тромбин, плазмин). Работа параферментов контролируется СИСТЕМОЙ ПРОТЕИНА "С". Протеин "С" – это гликопротеин, который содержит карбоксиглутаминовую кислоту, его синтез зависит от витамина "К". Существует в крови в виде профермента, активируется тромбином. Активный протеин "С" активирует фV и фVIII, переводя их в фVа и фVIIIа путем ограниченного протеолиза. В плазме крови есть эндогенный ингибитор протеина "С". Считается, что система свертывания крови работает всегда: одновременно происходит образование и растворение фибриновых сгустков благодаря тому, что работа системы свертывания крови уравновешивается работой системы фибринолиза. Фибринолиз – это расщепление фибринполимера на отдельные пептиды, которое катазируется ПЛАЗМИНОМ. Плазмин – сериновая протеиназа, способен гидролизовать фибрин, фибриноген и др. Сам плазмин образуется из плазминогена под действием АКТИВАТОРА ПЛАЗМИНОГЕНА. Тканевой активатор плазминогена неактивен до тех пор, пока не вступит в контакт с фибрином. Контактируя с фибрином, он приобретает способность активировать плазминоген. Когда фибрин будет гидролизован плазмином, активатор плазминогена теряет свою активность. ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ СИСТЕМЫ СВЕРТЫВАНИЯ КРОВИ И ФИБРИНОЛИЗА: 1. Это многокомпонентная система, в которой продукт предыдущей реакции служит ферментом для следующей. 2. Система свертывания крови – это разветвленная мультиферментная система, работающая по принципу каскадности (усиление первично слабого сигнала). 3. Оба механизма свертывания сливаются на уровне активации протромбина – это единая система, потому что активация одного механизма приводит к включению другого. 4. Система саморегулируется по принципу обратной связи.
Взаимосвязь процессов обмена веществ в организме. В виде схемы представить примеры взаимных переходов отдельных структурных элементов белков, жиров, углеводов в процессе их превращения и обмена.
Живой организм и его функционирование зависят от окружающей среды. Обмен веществ в организме человека протекает интегрировано и тонко настроено. В организме человека не существует самостоятельного обмена белков, жиров, углеводов и нуклеиновых кислот. Все превращения объединены в целостный процесс метаболизма. Существует четыре главных этапа распада молекул углеводов, белков и жиров, которые образуют энергию из основных пищевых источников. На первом этапе полисахариды расщепляются до моносахаридов, жиры распадаются на глицерин и высшие жирные кислоты, а белки расщепляются на свободные аминокислоты. На втором этапе мономерные молекулы подвергаются дальнейшему распаду, образуя фосфатные соединения и ацетил-КоА. На третьем этапе ацетил-КоА и другие метаболиты подвергаются окислению в цикле Кребса. На четвертом этапе происходит перенос электронов от восстановленных нуклеотидов на кислород через дыхательную цепь. Взаимосвязь между этими классами веществ осуществляется через общие промежуточные метаболиты и энергетические потребности организма.
Физиология [ править | править код ]
Процесс остановки кровотечения заключается в образовании тромбоцитарно-фибринового сгустка. Этот процесс можно разделить на три стадии [3]:
- временный (первичный) сокращение сосудов;
- образование тромбоцитарной пробки путем склеивания и сгусткования тромбоцитов;
- сокращение и уплотнение тромбоцитарной пробки.
Повреждение сосудов немедленно активирует тромбоциты. Тромбоциты прилипают к волокнам соединительной ткани по краям раны благодаря гликопротеину фактора Виллебранда [4]. В то же время происходит склеивание тромбоцитов: активированные тромбоциты присоединяются к поврежденным тканям и друг к другу, образуя преграду для потери крови. Так образуется тромбоцитарная пробка [3].
Активированные и склеившиеся тромбоциты высвобождают различные биологически активные вещества (АДФ, адреналин, норадреналин и другие), которые приводят к вторичному, необратимому склеиванию. Вместе с высвобождением тромбоцитарных факторов образуется тромбин [3], который воздействует на фибриноген и образует сеть фибрина, в которой запутываются эритроциты и лейкоциты – образуется тромбоцитарно-фибриновый сгусток (тромбоцитарная пробка). Благодаря контрактильному белку тромбостенину тромбоциты сближаются, тромбоцитарная пробка сокращается и уплотняется, происходит ее сжатие [3].
Процесс свёртывания крови [ править | править код ]
Процесс свертывания крови представляет собой в основном каскад ферментных реакций, в котором ферменты активируют другие факторы свертывания крови [3]. Процесс свертывания крови можно разделить на три фазы:
- Фаза активации включает последовательность реакций, приводящих к образованию протромбиназы и превращению протромбина в тромбин;
- Фаза коагуляции – образование фибрина из фибриногена;
- Фаза ретракции – образование плотного фибринового сгустка.
Эта схема была предложена Моравицем еще в 1905 году [5] и до сих пор остается актуальной [6].
С 1905 года был сделан значительный прогресс в понимании процесса свертывания крови. Были открыты десятки новых белков и реакций, участвующих в этом каскадном процессе. Сложность этой системы обусловлена необходимостью регуляции процесса.
Современное представление о каскаде реакций, сопровождающих свертывание крови, представлено на рисунках 2 и 3. При разрушении тканевых клеток и активации тромбоцитов высвобождаются фосфолипопротеины, которые вместе с факторами плазмы Xa и Va, а также ионами Ca 2+ образуют ферментный комплекс, активирующий протромбин. Если свертывание начинается под воздействием фосфолипопротеинов, выделяемых из поврежденных сосудов или соединительной ткани, это называется внешней системой свертывания крови (внешний путь активации свертывания, или путь тканевого фактора). Основными компонентами этого пути являются 2 белка: фактор VIIа и тканевый фактор, комплекс этих 2 белков также называется комплексом внешней теназы.
Если свертывание инициируется факторами свертывания, присутствующими в плазме, это называется внутренней системой свертывания. Комплекс факторов IXа и VIIIa, образующийся на поверхности активированных тромбоцитов, называется внутренней теназой. Таким образом, фактор X может активироваться как комплексом VIIa-TF (внешняя теназа), так и комплексом IXa-VIIIa (внутренняя теназа). Внешняя и внутренняя системы свертывания крови дополняют друг друга [5].
В процессе адгезии форма тромбоцитов меняется – они становятся округлыми клетками с шиповидными отростками. Под влиянием АДФ (частично выделяется из поврежденных клеток) и адреналина способность тромбоцитов к агрегации повышается. При этом из них выделяются серотонин, катехоламины и ряд других веществ. Под их влиянием происходит сужение просвета поврежденных сосудов, возникает функциональная ишемия. В конечном итоге сосуды перекрываются массой тромбоцитов, присоединенных к краям коллагеновых волокон по краям раны [5].
На этой стадии гемостаза под влиянием тканевого тромбопластина образуется тромбин. Именно он инициирует необратимую агрегацию тромбоцитов. Взаимодействуя с рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Ca 2+.
При наличии ионов кальция в крови под воздействием тромбина происходит полимеризация растворимого фибриногена (см. фибрин) и образование нерастворимой сети волокон фибрина. В этих нитях начинают фильтроваться форменные элементы крови, создавая дополнительную прочность всей системе, и через некоторое время образуется тромбоцитарно-фибриновый сгусток (физиологический тромб), который закупоривает место разрыва, предотвращая потерю крови и блокируя проникновение в кровь внешних веществ и микроорганизмов. На свертывание крови влияет множество факторов. Например, катионы ускоряют процесс, а анионы замедляют его. Кроме того, существуют вещества, полностью блокирующие свертывание крови (гепарин, гирудин и другие), а также активирующие его (яд гюрзы, феракрил).
Врожденные нарушения системы свертывания крови называют гемофилией.
Методы диагностики свёртывания крови [ править | править код ]
Все разнообразие клинических тестов свертывающей системы крови можно разделить на две группы [7]:
- глобальные (интегральные, общие) тесты;
- "локальные" (специфические) тесты.
Глобальные тесты характеризуют результат работы всего каскада свертывания. Они подходят для диагностики общего состояния свертывающей системы крови и выраженности патологий, с одновременным учетом всех привходящих факторов влияний. Глобальные методы играют ключевую роль на первой стадии диагностики: они дают интегральную картину происходящих изменений в свертывающей системе и позволяют предсказывать тенденцию к гипер- или гипокоагуляции в целом. "Локальные" тесты характеризуют результат работы отдельных звеньев каскада свертывающей системы крови, а также отдельных факторов свертывания. Они незаменимы для возможного уточнения локализации патологии с точностью до фактора свертывания. Для получения полной картины работы гемостаза у пациента врач должен иметь возможность выбирать, какой тест ему необходим.
-
определение времени свертывания цельной крови (методы Сухарева, Мас-Магро, Моравица);
-
тромбоэластография;
-
тест генерации тромбина (тромбиновый потенциал, эндогенный тромбиновый потенциал);
-
тромбодинамика.
-
активированное частичное тромбопластиновое время (АЧТВ);
-
тест протромбинового времени (или протромбиновый тест, МНО, ПВ);
-
узкоспециализированные методы для выявления изменений в концентрации отдельных факторов.
Все методы, измеряющие промежуток времени с момента добавления реагента (активатора, запускающего процесс свертывания) до формирования фибринового сгустка в исследуемой плазме, относятся к клоттинговым методам (от англ. clot – сгусток).
Нарушения свёртывания крови [ править | править код ]
Недостаток определенных факторов свертывания крови или наличие иммунных ингибиторов в крови могут привести к нарушениям свертываемости крови.
Частые вопросы
Какие факторы влияют на внешний путь свертывания крови?
Внешний путь свертывания крови зависит от наличия и активности факторов свертывания внутри сосудов, а также от состояния сосудистой стенки.
Какие факторы влияют на внутренний путь свертывания крови?
Внутренний путь свертывания крови зависит от наличия и активности факторов свертывания внутри самой крови, а также от состояния тромбоцитов.
Какие факторы могут нарушить внешний путь свертывания крови?
Нарушения внешнего пути свертывания крови могут быть вызваны нарушением сосудистой стенки (например, при атеросклерозе) или недостаточным количеством или активностью факторов свертывания внутри сосудов.
Какие факторы могут нарушить внутренний путь свертывания крови?
Нарушения внутреннего пути свертывания крови могут быть вызваны нарушением активности факторов свертывания внутри самой крови или недостаточным количеством тромбоцитов.
Какие заболевания могут быть связаны с нарушением свертываемости крови?
Нарушение свертываемости крови может быть связано с различными заболеваниями, такими как гемофилия, тромбофилия, тромбозы, геморрагические диатезы и другие нарушения системы свертывания крови.
Полезные советы
СОВЕТ №1
Поддерживайте здоровый образ жизни и следите за своим питанием. Употребление пищи, богатой витаминами К и С, помогает укрепить стенки сосудов и улучшить свертываемость крови. Включите в свой рацион овощи, фрукты, зелень, цитрусовые, ягоды, зеленый чай, орехи и рыбу.
СОВЕТ №2
Помните о важности физической активности. Регулярные умеренные физические нагрузки способствуют улучшению кровообращения и предотвращению образования тромбов. Рекомендуется заниматься аэробными упражнениями, такими как ходьба, плавание, велосипедная езда или занятия на тренажерах.